PROPIEDADES GENERALES DE LOS ALCOHOLES

.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)
Los alcoholes son compuestos que presentan en la cadena carbonada uno o más grupos Hidroxi u oxidrilo.
Los alcoholes suelen ser líquidos incoloros de olor característico, solubles en el agua en proporción variable y menos densos que ella. Al aumentar la masa molecular, aumentan sus puntos de fusión y ebullición, pudiendo ser sólidos a temperatura ambiente (p.e. el pentaerititrol funde a 260 °C). A diferencia de los alcanos de los que derivan, el grupo funcional hidroxilo permite que la molécula sea soluble en agua debido a la similitud del grupo hidroxilo con la molécula de agua y le permite formar enlaces de hidrógeno. La solubilidad de la molécula depende del tamaño y forma de la cadena alquílica, ya que a medida que la cadena alquílica sea más larga y más voluminosa, la molécula tenderá a parecerse más a un hidrocarburo y menos a la molécula de agua, por lo que su solubilidad será mayor en disolventes apolares, y menor en disolventes polares. Algunos alcoholes (principalmente polihidroxílicos y con anillos aromáticos) tienen una densidad mayor que la del agua.
El hecho de que el grupo hidroxilo pueda formar enlaces de hidrógeno también afecta a los puntos de fusión y ebullición de los alcoholes. A pesar de que el enlace de hidrógeno que se forma sea muy débil en comparación con otros tipos de enlaces, se forman en gran número entre las moléculas, configurando una red colectiva que dificulta que las moléculas puedan escapar del estado en el que se encuentren (sólido o líquido), aumentando así sus puntos de fusión y ebullición en comparación con sus alcanos correspondientes. Además, ambos puntos suelen estar muy separados, por lo que se emplean frecuentemente como componentes de mezclas anticongelantes. Por ejemplo, el 1,2-etanodiol tiene un punto de fusión de -16 °C y un punto de ebullición de 197 °C.
PROPIEDADES QUÍMICAS DE LOS ALCOHOLES
• Reacciones de alcoholes.
Los alcoholes pueden comportarse como ácidos o bases gracias a que el grupo funcional
es similar al agua
por lo que se establece un dipolo muy parecido al que presenta la molécula
de agua.

Por un lado, si se enfrenta un alcohol con una base fuerte o con un hidruro de metal alcalino se forma el grupo alcoxi, en donde el grupo hidroxilo se desprotona dejando al oxígeno con carga negativa. La acidez del grupo hidroxilo es similar a la del agua, aunque depende fundamentalmente del impedimento estérico y del efecto inductivo. Si un hidroxilo se encuentra enlazado a un carbono terciario, éste será menos ácido que si se encontrase enlazado a un carbono secundario, y a su vez éste sería menos ácido que si estuviese enlazado a un carbono primario, ya que el impedimento estérico impide que la molécula se solvate de manera efectiva. El efecto inductivo aumenta la acidez del alcohol si la molécula posee un gran número de átomos electronegativos unidos a carbonos adyacentes (los átomos electronegativos ayudan a estabilizar la carga negativa del oxígeno por atracción electrostática).
Por otro lado, el oxígeno posee 2 pares electrónicos no compartidos por lo que el hidroxilo podría protonarse, aunque en la práctica esto conduce a una base muy débil, por lo que para que este proceso ocurra, es necesario enfrentar al alcohol con un ácido muy fuerte.
Halogenación de alcoholes
Para fluorar cualquier alcohol se requiere del 'reactivo de Olah.
Para clorar o bromar alcoholes, se deben tomar en cuenta las siguientes consideraciones:
1. Alcohol primario: los alcoholes primarios reaccionan muy lentamente. Como no pueden formar carbocationes, el alcohol primario activado permanece en solución hasta que es atacado por el ion cloruro. Con un alcohol primario, la reacción puede tomar desde treinta minutos hasta varios días.
2. Alcohol secundario: los alcoholes secundarios tardan menos tiempo, entre 5 y 20 minutos, porque los carbocationes secundarios son menos estables que los terciarios.
3. Alcohol terciario: los alcoholes terciarios reaccionan casi instantáneamente, porque forman carbocationes terciarios relativamente estables.
Los alcoholes terciarios reaccionan con ácido clorhídrico directamente para producir el cloroalcano terciario, pero si se usa un alcohol primario o secundario es necesaria la presencia de un ácido de Lewis, un "activador", como el cloruro de zinc. Como alternativa la conversión puede ser llevada a cabo directamente usando cloruro de tionilo (SOCl2). Un alcohol puede también ser convertido a bromoalcano usando ácido bromhídrico o tribromuro de fósforo (PBr3), o a yodoalcano usando fósforo rojo y yodo para generar "in situ" el triyoduro de fósforo. Dos ejemplos:
(H3C)3C-OH + HCl → (H3C)3C-Cl + H2O
CH3-(CH2)6-OH + SOCl2 → CH3-(CH2)6-Cl + SO2 + HCl
PROPIEDADES FISICAS
Las propiedades físicas de un alcohol se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua.
Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua),
similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol.
A partir de 4 carbonos en la cadena de un alcohol,
su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo.
A partir del hexanol son solubles solamente en solventes orgánicos.
Punto de Ebullición:
Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que
el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones.
BENEFICIOS DEL ALCOHOL
Previene enfermedades del corazón: Se dice que los antioxidantes en el vino tinto ayudan a la salud del corazón y el sistema cardiovascular. Las personas activas, que consumen por lo menos una bebida alcohólica a la semana, tienen un 50% menos de probabilidades de desarrollar una enfermedad cardíaca que una persona que se pasa todo el día frente al televisor.
Aumenta el colesterol 'bueno': La cerveza y el vino pueden aumentar el nivel de lipoproteínas de alta densidad (HDL, en inglés) que son capaces de retirar el colesterol de las arterias y transportarlo de vuelta al hígado para su excreción, lo que ayuda a evitar enfermedades como la arteriosclerosis. Sin embargo, hay que tener cuidado con las calorías de la cerveza, especialmente las de las oscuras; el abdomen podría sufrir las consecuencias.
Reduce la artritis: El alcohol puede disminuir considerablemente las posibilidades de contraer artritis en la vejez. Sin embargo, su consumo excesivo pude aumentar el riesgo de desarrollar la osteoporosis. Así, mientras una copa de vino puede evitar el dolor persistente de los huesos, también puede volverlos más propensos a romperse como ramitas. La solución: un 'ruso blanco', un cóctel de vodka con leche, que podría ayudar a los huesos de las dos maneras.
Aumenta la fibra: Al derivar de granos, la cerveza es realmente una fuente de buena fibra dietética, buena para aliviar algunos problemas de estreñimiento, hemorroides, diverticulosis y síndrome de intestino (colon) irritable. De hecho, medio litro (unas dos tazas) de cerveza puede proporcionar más de un cuarto de su ingesta diaria necesaria de fibra. Pero tenga cuidado, demasiada fibra puede conducir a visitar el inodoro más veces de lo debido.
Previene ciertos tipos de cáncer: Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas: Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
Salva vidas: Así es, pero de una manera muy particular. En caso de que, por alguna razón, llegara a ingerir anticongelante, una maratón de tragos de vodka o whisky puede salvarle la vida. ¡Es verdad! El alcohol actúa anulando los efectos peligrosos del etilenglicol, el componente principal en los anticongelantes.
El compuesto más representativo es el alcohol etílico o etanol ,usado en la producción de bebidas como vino, aguardientes, cervezas, su formula es CH3-CH2-OH (C2H60)
RIESGOS DE EL ALCOHOL
Metanol
Entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de FischerTropsch entre el monóxido de carbono y el hidrógeno, de la que
se obtiene metanol como subproducto. También se produce
mediante la oxidación directa de hidrocarburos o mediante un
proceso de hidrogenación en dos etapas en el que se hidrogena el
monóxido de carbono para dar formiato de metilo, que a su vez
se hidrogena para obtener alcohol metílico. Sin embargo, la
síntesis más importante es la realizada mediante hidrogenación
catalítica a presión del monóxido de carbono o del dióxido de
carbono, a presiones de 100-600 kgf/cm2
y temperaturas
de 250-400 ºC.
El alcohol metílico tiene propiedades tóxicas que pueden
hacerse evidentes tanto por exposición aguda como crónica. Los
alcohólicos que ingieren este líquido o los trabajadores que
inhalan sus vapores pueden sufrir lesiones. En experimentos con
animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal.
En casos de intoxicación grave, generalmente por ingestión, el
alcohol metílico actúa de forma específica en el nervio óptico,causando ceguera como resultado de la degeneración del nervio
óptico, acompañada de cambios degenerativos en las células
ganglionares de la retina y trastornos circulatorios en la coroides.
La ambliopía es normalmente bilateral y puede aparecer pocas
horas después de la ingestión, mientras que la ceguera total no se
instaura hasta pasada una semana. Las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta
escotoma central; las funciones respiratorias y cardiovasculares
están deprimidas y, en los casos muy graves, el paciente está
inconsciente, si bien el coma puede ir precedido de delirio.
Las consecuencias de la exposición industrial a los vapores de
alcohol metílico pueden variar considerablemente de un trabajador a otro. Bajo diferentes condiciones de intensidad y duración
de la exposición, los síntomas de la intoxicación son: irritación
de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio,
nistagmo, dilatación de las pupilas, visión borrosa, náuseas,
vómitos, cólicos y estreñimiento. Pueden producirse lesiones cutá-
neas por la acción irritante y disolvente del alcohol metílico y
también por la acción lesiva de los tintes y resinas disueltas en él.
Estas lesiones se localizan preferentemente en las manos, las
muñecas y los antebrazos. No obstante, la causa de estos efectos
perjudiciales se debe en general a exposiciones prolongadas a
concentraciones muy superiores a los límites recomendados por
las autoridades para prevenir la intoxicación por inhalación de
vapores de alcohol metílico.
Se ha sugerido que la exposición crónica combinada a metanol
y monóxido de carbono es un factor causante de aterosclerosis
cerebral.
La acción tóxica del alcohol metílico se atribuye a oxidación
metabólica en ácido fórmico o formaldehído, producto éste que
tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. Estos procesos de oxidación pueden ser
inhibidos por el alcohol etílico.
Etanol
Un riesgo industrial frecuente es la exposición a vapores en
la proximidad de un proceso en el que se utiliza alcohol etílico.
La exposición prolongada a concentraciones superiores a
5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor,
fatiga y narcosis. El alcohol etílico se oxida muy rápidamente en
el organismo a dióxido de carbono y agua. El alcohol no oxidado
se excreta en la orina y en el aire espirado, de manera que apenas
se producen efectos acumulativos. Su efecto en la piel es similar al
de todos los disolventes de grasas y, de no tomarse las debidas
precauciones, puede producirse una dermatitis de contacto.
Recientemente se ha sospechado la existencia de otro riesgo
potencial en las personas expuestas a etanol sintético, por haberse
demostrado que este producto es cancerígeno en ratones tratados
con dosis altas. Un estudio epidemiológico posterior ha revelado
una mayor incidencia de cáncer de laringe (cinco veces superior a
la prevista) en un grupo de trabajadores empleados en una
fábrica de etanol obtenido mediante ácidos fuertes. Parece ser
que el agente causal fue el sulfato de dietilo, aunque también
estaban implicados las alquil sulfonas y otros posibles
cancerígenos.
El alcohol etílico es un líquido inflamable y sus vapores forman
mezclas inflamables y explosivas con el aire a temperatura
ambiente. Una solución acuosa con un 30 % de alcohol puede
producir una mezcla inflamable de vapor y aire a 29 ºC. Otra
que contenga solamente un 5 % de alcohol puede producirla a
62 ºC.
La ingestión es poco probable en el entorno industrial, pero
posible en el caso de los alcohólicos. El peligro de este consumo
anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la
presencia de desnaturalizantes. Estos últimos se añaden para
hacer que el alcohol tenga un sabor desagradable cuando se
obtiene libre de impuestos para fines distintos al del consumo.
Muchos de estos desnaturalizantes (p. ej. alcohol metílico,
benceno, bases de piridina, metilisobutilcetona, queroseno,
acetona, gasolina, dietilftalato, etc.) son más peligrosos para la
persona que lo consuma que el propio alcohol etílico. Por todo
ello es muy importante asegurarse de que no se produce consumo
ilegal de alcohol etílico destinado a usos industriales
n-Propanol
No se han notificado casos de intoxicación relacionados con el
uso industrial de n-propanol. Para los animales de experimentación
es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. Irrita las mucosas y deprime el sistema
nervioso central. Cuando se inhala, produce una leve irritación
del aparato respiratorio y ataxia. Es algo más tóxico que el
alcohol isopropílico, pero aparentemente provoca los mismos
efectos biológicos. Se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. Los cambios morfopatológicos
observados fueron principalmente edema cerebral y pulmonar,
también presentes con frecuencia en la intoxicación etílica. El
n-propanol es inflamable y representa un riesgo moderado de
incendio.
Otros compuestos
El isopropanol es ligeramente tóxico para los animales de experimentación cuando se administra por vía dérmica y moderadamente tóxico por vía oral e intraperitoneal. No se conoce ningún
caso de intoxicación industrial, aunque sí se ha detectado una
mayor incidencia de cánceres de senos nasales y laringe en trabajadores que participaban en la producción de alcohol isopropí-
lico. La causa podría ser el contacto con aceite isopropílico, que
se obtiene como subproducto. La experiencia clínica demuestra
que el alcohol isopropílico es más tóxico que el etanol, pero
menos que el metanol. El isopropanol se metaboliza en el organismo dando acetona, que puede alcanzar concentraciones
elevadas y, a su vez, es metabolizada y se excretada por los
riñones y los pulmones. En el ser humano, las concentraciones de
400 ppm producen irritación leve de ojos, nariz y garganta.
El curso clínico de la intoxicación por isopropanol es semejante al de la intoxicación por etanol. La ingestión de hasta 20 ml
diluidos en agua causa solamente una suave sensación de calor y
un ligero descenso de la presión sanguínea. No obstante, en dos
casos mortales de intoxicación aguda, unas horas después de la
ingestión se produjo parada respiratoria, coma profundo e hipotensión, lo que se considera un signo de mal pronóstico. El
isopropanol es un líquido inflamable que conlleva peligro de
incendio.
El n-butanol es potencialmente más tóxico que cualquiera de sus
homólogos inferiores, pero los riesgos prácticos asociados a su
producción industrial y a su uso a temperatura ambiente son muy
pequeños debido a su escasa volatilidad. Las altas concentraciones de vapor producen narcosis y muerte en los animales. La
exposición del ser humano a los vapores puede causar irritación
de las mucosas. Las concentraciones que producen irritación
varían entre 50 y 200 ppm. Con más de 200 ppm pueden presentarse edema leve transitorio ocular de la conjuntiva y un recuento
de eritrocitos ligeramente reducido. El contacto del líquido con la
piel provoca irritación, dermatitis y absorción. Es ligeramente
tóxico cuando se ingiere y conlleva también peligro de incendio.
La reacción de los animales a los vapores de sec-butanol es
similar a la observada con n-butanol, si bien el primero es más
narcótico y letal. Es un líquido inflamable con peligro de
incendio.
A elevadas concentraciones, la acción de los vapores de isobutanol es principalmente narcótica, como también ocurre con otros
alcoholes. Produce irritación ocular cuando la concentración
supera los 100 ppm. El contacto del líquido con la piel puede
causar eritema. Es ligeramente tóxico por ingestión. Es un líquido
inflamable con peligro de incendio.
Si bien los vapores de terc-butanol son más narcóticos que los del
n - o isobutanol para el ratón, hasta ahora se han notificado pocos
casos de intoxicación relacionados con su uso industrial, salvo
una leve irritación ocasional de la piel. Es ligeramente tóxico por
ingestión. Además, es inflamable y constituye un riesgo
importante de incendio.
La exposición prolongada a vapor de ciclohexanol puede
producir cefalea e irritación de la conjuntiva, aunque no existen
riesgos industriales graves. A una concentración de 100 ppm
produce irritación de ojos, nariz y garganta. El contacto prolongado del líquido con la piel causa irritación, y el líquido se
absorbe lentamente a través de la piel. Es ligeramente tóxico
cuando se ingiere. El ciclohexanol se excreta en la orina, conjugado con ácido glucurónico. El líquido es inflamable y entraña
un peligro moderado de incendio.
La exposición prolongada a los vapores de metilciclohexanol
puede causar cefalea e irritación de los ojos y del tracto respiratorio superior. El contacto prolongado del líquido con la piel
produce irritación, y el líquido se absorbe lentamente a través de
la piel. Es ligeramente tóxico por ingestión y se excreta en la
orina, conjugado con ácido glucurónico. Conlleva un peligro
moderado de incendio.
La exposición a vapores altamente concentrados de una
mezcla que contenía alcohol bencílico, benceno y ésteres como
disolvente sólo produjo cefalea, vértigo, náuseas, diarrea y
pérdida de peso, todos ellos pasajeros, sin que se haya producido
ningún caso de enfermedad industrial relacionado con el alcohol
bencílico. Esta sustancia produce una leve irritación de la piel y un
leve lagrimeo. El líquido es inflamable y conlleva un peligro
moderado de incendio.
El alcohol alílico es un líquido inflamable e irritante. Causa irritación en contacto con la piel, y la absorción a través de la piel da
lugar a un dolor profundo en la región donde se ha producido la
absorción, además de lesiones sistémicas. Si el líquido penetra en
los ojos, puede producir quemaduras graves. Los vapores no
poseen propiedades narcóticas serias, pero ejercen un efecto irritante sobre las mucosas y el sistema respiratorio cuando se
inhalan como contaminante atmosférico. Su presencia en una
atmósfera industrial puede causar lagrimeo, dolor en los ojos y
visión borrosa (necrosis de la córnea, hematuria y nefritis)
USOS DE LOS ALCOHOLES
Los alcoholes se utilizan como productos químicos intermedios y
disolventes en las industrias de textiles, colorantes, productos
químicos, detergentes, perfumes, alimentos, bebidas, cosméticos,
pinturas y barnices. Algunos compuestos se utilizan también en la
desnaturalización del alcohol, en productos de limpieza, aceites
y tintas de secado rápido, anticongelantes, agentes espumígenos
y en la flotación de minerales
-El n-propanol es un disolvente utilizado en lacas, cosméticos,
lociones dentales, tintas de impresión, lentes de contacto y
líquidos de frenos. También sirve como antiséptico, aromatizante
sintético de bebidas no alcohólicas y alimentos, producto químico
intermedio y desinfectante
-El n-butanol se emplea como disolvente de pinturas, lacas,
barnices, resinas naturales y sintéticas, gomas, aceites vegetales,
tintes y alcaloides. Se utiliza como sustancia intermedia en la
fabricación de productos químicos y farmacéuticos, y en las
industrias de cuero artificial, textiles, gafas de seguridad, pastas
de caucho, barnices de laca, impermeables, películas fotográficas
y perfumes. El sec-butanol se utiliza también como disolvente y
producto químico intermedio, y se encuentra en líquidos hidráulicos de frenos, limpiadores industriales, abrillantadores, decapantes de pinturas, agentes de flotación para minerales, esencias
de frutas, perfumes y colorantes
-El isobutanol , un disolvente para revestimientos de superficie y
adhesivos, se emplea en lacas, decapantes de pinturas, perfumes,
productos de limpieza y líquidos hidráulicos. El terc-butanol se
utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como
producto químico intermedio.
etc
BIBLIOGRAFIA
http://kimiexplorer.wikispaces.com/Alcoholes
https://www.dropbox.com/s/2sqstc753mus2x8/propiedad%20de%20los%20alcoholes.pdf
https://www.google.com.co/search?=N&tab=wi&ei=m4nsUdvBJY729gTYkoDQBw&biw=1366&bih=667&sei=nYnsUaPKGvKv4APauIGABA#imgdii=_
http://kira2629.wordpress.com/2009/06/20/propiedades-fisicas-y-quimicas-de-los-eteres/
http://www2.udec.cl/matpel/sustanciaspdf/e/ETERDIETILICO.pdf
ETERES

Los éteres alcohólicos son los que se obtienen por combinación de dos moléculas de alcohol con formación de una molécula de agua.
El agua se origina por la unión del (OH) de un alcohol con el átomo de hidrógeno del (OH) del otro alcohol.
Podemos encontrar dos tipos de éteres:
Éteres simples: Son los que tienen ambos restos alcohólicos iguales.
Éteres mixtos: Son los que tienen los dos restos de diferentes tamaños por ser de alcoholes distintos.
CH3 — CH2 — O — CH2 — CH2 — CH3 CH3 — CH2 — O — CH2 — CH3
etano – oxi – propano éter etil etílico
Otro criterio de clasificación es si pertenecen a restos alifáticos o aromáticos.
Hay dos nomenclaturas para designar a los éteres. La oficial los nombra con la palabra de los alcanos que originaron a los alcoholes enganchadas entre sí con el nexo “oxi”. Como se observa arriba en ambos ejemplos. Otra manera es nombrarlos con la palabra éter seguida de los nombres de los radicales alcohólicos en orden creciente de pesos moleculares.
Por ejemplo el etano –oxi- etano se nombra también como éter etil-etílico. Y el etano –oxi- propano se nombra como éter etil propílico.
Las reglas se mantienen para los éteres fenólicos.
Obtención de éteres:
![]()
Deshidratando alcoholes: Se usa ácido sulfúrico como deshidratante a unos 140°C para incrementar la formación del éter.
2 CH3 — CH2 — OH ———–> CH3 — CH2 — O — CH2 — CH3 + H2O
etanol etano – oxi – etano
Síntesis de Williamson:
En este proceso se combina un alcoholato de sodio con un yoduro de alquilo y usando altas temperaturas. Permite armar éteres de distintas cadenas (mixtos).
CH3 — CH2 — ONa + CH3 — CH2 — CH2I —-> CH3 — CH2 —O—(CH2)2 — CH3 + INa
Etanolato de sodio Ioduro de propilo Etano oxi Propano Ioduro de sodio
« Esteres
Aminas. Propiedades e Importancia »
23 oct Eteres
Los éteres alcohólicos son los que se obtienen por combinación de dos moléculas de alcohol con formación de una molécula de agua.
El agua se origina por la unión del (OH) de un alcohol con el átomo de hidrógeno del (OH) del otro alcohol.
Podemos encontrar dos tipos de éteres:
Éteres simples: Son los que tienen ambos restos alcohólicos iguales.
Éteres mixtos: Son los que tienen los dos restos de diferentes tamaños por ser de alcoholes distintos.
CH3 — CH2 — O — CH2 — CH2 — CH3 CH3 — CH2 — O — CH2 — CH3
etano – oxi – propano éter etil etílico
Otro criterio de clasificación es si pertenecen a restos alifáticos o aromáticos.
Hay dos nomenclaturas para designar a los éteres. La oficial los nombra con la palabra de los alcanos que originaron a los alcoholes enganchadas entre sí con el nexo “oxi”. Como se observa arriba en ambos ejemplos. Otra manera es nombrarlos con la palabra éter seguida de los nombres de los radicales alcohólicos en orden creciente de pesos moleculares.
Por ejemplo el etano –oxi- etano se nombra también como éter etil-etílico. Y el etano –oxi- propano se nombra como éter etil propílico.
Las reglas se mantienen para los éteres fenólicos.
Obtención de éteres:
![]()
Deshidratando alcoholes: Se usa ácido sulfúrico como deshidratante a unos 140°C para incrementar la formación del éter.
2 CH3 — CH2 — OH ———–> CH3 — CH2 — O — CH2 — CH3 + H2O
etanol etano – oxi – etano
Síntesis de Williamson:
En este proceso se combina un alcoholato de sodio con un yoduro de alquilo y usando altas temperaturas. Permite armar éteres de distintas cadenas (mixtos).
CH3 — CH2 — ONa + CH3 — CH2 — CH2I —-> CH3 — CH2 —O—(CH2)2 — CH3 + INa
Etanolato de sodio Ioduro de propilo Etano oxi Propano Ioduro de sodio
Propiedades Físicas:
Sus puntos de ebullición son menores que los alcoholes que lo formaron pero son similares a los alcanos de pesos moleculares semejantes. A diferencia de los alcoholes no establecen uniones puente de hidrógeno y esto hace que sus puntos de ebullición sean significativamente menores.
Son algo solubles en agua. Son incoloros y al igual que los ésteres tienen olores agradables. El más pequeño es gaseoso, los siguientes líquidos y los más pesados sólidos.
Propiedades Químicas:
No tienen hidrógenos activos como en los casos de los alcoholes o ácidos. Por este motivo son inertes ante metales como el sodio o potasio o litio. Necesitan del calor para descomponerse y ahí si poder reaccionar con algunos metales.
CH3 — CH2 –O–(CH2)2— CH3 + 2 Na —–> CH3 — CH2 O Na + CH3 — CH2 — CH2 Na
Etano oxi Propano Etanolato de sodio sodio propilo
Oxidación: Ante agentes oxidantes fuertes como el Dicromato de potasio, los éteres se oxidan dando aldehídos.
CH3 — CH2 —O—(CH2)2— CH3 —-> CH3 — HC = O + CH3 — CH2 — HC = O + H2O
Etano oxi Propano O2 Etanal Propanal
USOS
Es un producto líquido a temperatura ambiente, muy volátil y extremadamente inflamable. Es incoloro de olor purgente dulce. Se usa como medio de reacción, disolvente, agente extractivo y anestésico general.
Aplicaciones Generales
Anestésico general.
Medio extractar para concentrar ácido acético y otros ácidos.
Medio de reacción en la síntesis WURTZ y de GRIGNARD.
Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
Combustible inicial de motores Diesel.
RIESGOS

BIBILIOGRAFIA
http://espanol.answers.yahoo.com/question/index?qid=20071021184146AAZ845X
http://es.scribd.com/doc/97994347/TABLAS-DE-ETERES-%E2%80%A2-Riesgos-para-la-salud
ESTERES

Los ésteres se forman por reacción entre un ácido y un alcohol. La reacción se produce con pérdida de agua. Se ha determinado que el agua se forma a partir del OH del ácido y el H del alcohol. Este proceso se llama esterificación.
Pueden provenir de ácidos alifáticos o aromáticos.
Se nombran como sales, reemplazando la terminación de los ácidos por oato seguido del nombre del radical del alcohol.
Ejemplo: etanoato de propilo es un éster formado a partir del ácido etanoico y el alcohol propílico.
Los ésteres pueden participar en los enlaces de hidrógeno como aceptadores, pero no pueden participar como donadores en este tipo de enlaces, a diferencia de los alcoholes de los que derivan. Esta capacidad de participar en los enlaces de hidrógeno les convierte en más hidrosolubles que los hidrocarburos de los que derivan. Pero las ilimitaciones de sus enlaces de hidrógeno los hace más hidrofóbicos que los alcoholes o ácidos de los que derivan. Esta falta de capacidad de actuar como donador de enlace de hidrógeno ocasiona el que no pueda formar enlaces de hidrógeno entre moléculas de ésteres, lo que los hace más volátiles que un ácido o alcohol de similar peso molecular.
Propiedades físicas:
Los de bajo peso molar son líquidos de olor agradable, similar al de la esencia de las frutas que los contienen. Los ésteres de ácidos superiores son sólidos cristalinos, inodoros. solubles en solventes orgánicos e insolubles en agua. Su densidad es menor que la del agua.
Propiedades químicas:
Hidrólisis ácida:Por calentamiento con agua se descompone en el alcohol y el ácido de los que proviene.
éster + agua ------------- ácido + alcohol
Con un exceso de agua la reacción es total. Es un proceso inverso a la esterificación.
CH3.CO.O.CH3 + H2O ------------ CH3.CO.OH + H.CH2.OH
USOS
Los ésteres son empleados en muchos y variados campos del comercio y de la industria, como los siguientes:
Disolventes
Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
Plastificantes
El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aromas artificiales, todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres
Muchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
Aditivos Alimentarios
Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos Farmacéuticos
Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros Diversos.
RIESGOS
Los estudios han mostrado daños en el hígado, riñones, pulmones y testículos. Por otra parte, un estudio japonés publicado en 2006 realizado con primates jóvenes no ha encontrado daños testiculares de ningún tipo. El Instituto de Sanidad y Protección al Consumidor de la Oficina Química Europea ha encontrado que dos de los ftalatos considerados peligrosos para el hombre y prohibidos en la UE (el DINF o diisononilftalato y el DIDP o diisodecilftalato) no suponen un riesgo para la salud humana o para el medio ambiente en su formas de uso actuales.
También causa confusión en animales como roedores.
El MINISTERIO DE SALUD ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de (TRES) 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos, ante la posibilidad de que tengan efectos adversos sobre la salud el COMITE CIENTIFICO SOBRE TOXICIDAD, ECOTOXICIDAD Y MEDIO AMBIENTE de la UNION EUROPEA ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de (TRES) 3 años.
Que hasta la fecha no se ha validado un método de migración específica de los ésteres de ácido ftálico a partir de los materiales que los contienen, bajo condiciones reales de uso, lo que impide el establecimiento de límites admisibles para la migración de los ésteres de ácido ftálico en juguetes y artículos de puericultura.
Que en ejercicio de la capacidad del Estado Nacional para determinar los requisitos esenciales de seguridad que deben cumplir los productos de venta libre y/o de uso masivo para garantizar a la población que las sustancias empleadas no comprometen su seguridad en condiciones previsibles de uso, el MINISTERIO DE SALUD dictó la Resolución N° 978/99.
Que atendiendo a que en otros países de la región carecen de iguales restricciones a estos productos y siendo la REPUBLICA ARGENTINA territorio de tránsito directo comercial entre algunos de ellos, el MINISTERIO DE SALUD por Resolución N° 268 de fecha 17 de abril de 2000 hizo inaplicable los términos de la Resolución N° 978/99 a la mercadería que arribe al territorio aduanero en tránsito directo con destino al exterior.
Que el 5 de septiembre próximo pasado la Comisión Europea prolongó por tercera vez la validez de la Decisión 1998/815/CE sobre medias relativas a la prohibición de la comercialización de juguetes y artículos de puericultura destinados a ser llevados a la boca.
Que si bien la restricción impuesta acota significativamente el riesgo a que están expuestos los niños menores de tres años, también es sabido que en esta etapa de la vida los niños presentan una fuerte tendencia a llevarse a la boca todo tipo de objetos, y no sólo aquellos diseñados a tal efecto, por lo que aparece conveniente establecer un procedimiento que permita identificar a los artículos dirigidos a este grupo etario que contengan los ésteres de ácido ftálico definidos como riesgosos para la salud.
BIBLIOGRAFIA
-http://es.answers.yahoo.com/question/index?qid=20090616154709AAnzwta
http://es.wikipedia.org/wiki/%C3%89ster#Propiedades_f.C3.ADsicas




.jpg)
.jpg)
.jpg)
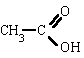



.jpg)
.jpg)
.jpeg)
.jpg)


.jpg)
.jpg)




.png)
.png)
.png)


.jpg&container=blogger&gadget=a&rewriteMime=image%2F*)



